

2022年3月29日,我院黄明东教授与生物科学与工程学院袁彩研究员团队合作在Nature Communications上发表了题为“Crystal structure and cellular functions of uPAR dimer”的研究论文。

尿激酶受体(uPAR)作为纤溶酶原激活系统的重要成员,其不仅可以通过结合细胞外纤溶系统蛋白酶-尿激酶(uPA)-来调节血栓纤维蛋白溶解和蛋白水解,还可激活许多细胞内信号通路。其通过协调细胞外基质(ECM)蛋白的水解和胞内信号传导达到调控细胞的黏附与移动、细胞增殖和存活。uPAR在正常组织中表达量低,但在炎症反应和组织重塑过程中以及在多种人类癌症中的表达量升高。因而,uPAR被广泛认为是癌症的标记物和治疗靶点。此外,可溶性尿激酶受体(suPAR)即尿激酶受体的细胞外片段,在血液中的升高提示存在健康危机(参见Science 2018,360:254-258或DOI: 10.1126/science.360.6386.254)。例如,在一些感染性疾病、自身免疫性炎症、肿瘤和肾病患者的血液循环中suPAR的蛋白水平明显升高。suPAR的血液水平在国外有广泛的应用报道,其不仅作为肿瘤、肾病等的标记物,还在欧洲哥本哈根等的医院中被作为急诊病人危重程度的分类的指标。
该研究通过X射线晶体学测定了uPAR二聚体结构,结构分析表明,两个uPAR分子是通过N端结构域上的前四个β链的相互替换而彼此紧密缠绕在一起(图1)。基于该结构,作者对结构域交换关键铰链区氨基酸进行定点变,确定了uPAR上的一个点突变E49P可促进二聚体的形成。该研究进一步比较该突变体、uPAR单体、野生型uPAR在细胞表面引起的细胞表型和功能差异。这些结果揭示了uPAR二聚化的结构基础及其对细胞功能的影响。该项工作提示了uPAR抑制剂的开发不能单纯考虑单体的结构,对深入寻找有价值的uPAR抑制剂,及研究uPAR与疾病的关系提供新的思路和方向,加速以uPAR为靶标的治疗方案的临床转化!
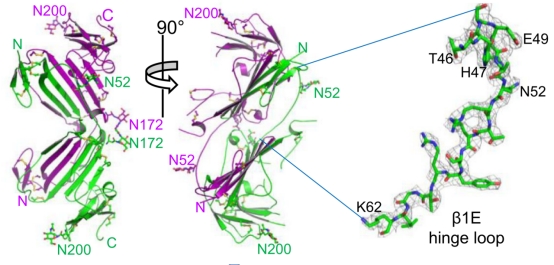
图1. 尿激酶受体形成N端交换的二聚体(两条链分别以绿色和紫色显示)
我院黄明东教授和生物科学与工程学院袁彩研究员为论文共同通讯作者,博士后余淑娟为第一作者。我院隋亚群硕士(已毕业)和李翰林博士研究生也参与了该项研究。该工作还得到了清华大学王佳伟副教授、赣南师范大学李永东教授、福建医科大学曹颖平教授、亚利桑那州立大学陈荔清研究员和我院江龙光副教授的大力支持。该研究得到了国家重点研发计划、国家自然科学基金、福建省科技创新重点项目、福建省自然科学基金以及福建亿彤生物科技公司的资助。黄明东教授/袁彩研究员团队长期从事uPAR结构、功能及靶向治疗方面的研究。该团队解析了uPAR与多种配体、抗体或小分子抑制剂的结构(Febs Letters, 2019,593:1236-47; Biochemistry, 2017,56:1768-84; Angewandte Chemie-International Edition, 2016,55:3642-6; Biochemical Journal, 2016, 473, 2359-2368; Journal of Molecular Biology, 2015, 427:1389-403; Plos One, 2014,9; Journal of Molecular Biology, 2012,416:629-41; Journal of biological chemistry,2010, 285:10982-10992; Nat Struct Mol Biol, 2008,15:422-423; Science, 2006,311:656-9),揭示了不同种属uPAR与配体及抑制剂相互作用的结构基础,为uPAR靶向分子的设计和优化奠定了基础。同时该团队还利用uPAR为靶向分子,对载体进行修饰,进行靶向性光动力学治疗(Theranostics, 2019,9:884-899; Acta Biomaterialia, 2015,23:116-26; Theranostics, 2014,4:642-659)。此外,该团队还发现了suPAR血液水平与新冠肺炎严重程度相关(Crit Care 2020,24:704),可用于指导新冠肺炎严重性分型。
原文链接:https://www.nature.com/articles/s41467-022-29344-y